 |
Fixace
|
Fixace je jedním z velmi důležitých kroků při přípravě mikroskopického preparátu. Obvykle je popisována jako proces, během něhož dochází k usmrcení a "zakonzervování" pletiva před jeho dalším zpracováním. Přestože tato "definice" není zcela přesná, jak uvidíme později, poukazuje na potřebu omezit změny vyvolané manipulací s pletivem. Ve chvíli, kdy se oddělí část pletiva od celistvého organismu, tak se v jeho buňkách rozbíhají některé procesy, které jej rychle vzdalují od jeho původního stavu (např. autolyze, reakce na poškození, vysychání, osmoticky způsobené změny, mikrobiální rozklad, ..), během dalšího zpracování (odvodnění, zalévání, barvení,...) mohou být některé komponenty rozpouštěny a vyplaveny použitými roztoky. Právě těmto a podobným změnám bychom rádi zabránily použitím fixace.
Už z několika výše uvedených bodů je zřejmé, že jejich současné splnění je
neproveditelné. Bude li požadováno co nejlepší zachování a maximální imobilizace
(např. bílkovin), tak lze asi velmi obtížně zachovat jejich enzymatickou, nebo
antigenní aktivitu. Fixace, která by splňovala všechna z těchto protichůdných
kritérií, prostě neexistuje. Navíc je pletivo příliš heterogenní systém s vysokou
chemickou diverzitou. Fixace optimalizovaná pro určitou složku, nemusí být optimální
pro složky ostatní.
Působení fixace není a nemůže být okamžité v celém objemu pletiva, ale záleží
na objemu pletiva a rychlosti pronikání fixativa.
Existuje poměrně široké spektrum postupů, fixačních činidel aplikovaných v různých
roztocích, nebo jejich směsí. Liší se výsledkem a stavem ve kterém zanechají
pletivo. Výběr vhodné fixace závisí na účelu pro který pletivo připravujeme
a postupech následujících po fixaci.
Př.:
Pro obecně morfologické pozorování uspořádání buněk (buněčných stěn) pletiva
je dostatečné použít k fixaci např. 50% etanol, FAA, nebo FPA. Pokud ale chceme
pozorovat cytologické detaily je nutné použít fixáž, která nám je zachová, např.
formaldehyd, nebo směs formaldehydu s glutaraldehydem.
Glutaraldehyd nám velmi dobře zachová jemné cytologické detaily, ale proniká
pomaleji než formaldehyd a vytváří rychleji daleko pevnější vazby. Jeho působení
ve srovnání s formaldehydem výrazně snižuje enzymatickou aktivitu (např esterázy,
peroxidázy) a není proto vhodný pro přípravu vzorků, u kterých chceme lokalizovat
enzymatickou aktivitu....
O tom jak fixace působí na některé komponenty nám může napovědět jejich klasifikace:
- Bílkoviny tvoří značnou část protoplasmy a proto je schopnost koagulovat
(srážet) bílkoviny jedním ze základních kritérií tradičně rozdělující fixativa
(Baker, 1958) na
- Dalším z kritérií pro rozdělení fixativ může být zda zůstávájí vázány v pletivu po ukončení fixace, nebo ne. Tento způsob dělení se do určité míry překrývá s výše uvedeným dělením.
- Tradičně se rozpoznávají dva druhy obrazu fixace (podle Johansena, 1940)
- Fixace změní některé charakteristiky materiálu buněk. Vzniká tak jakýsi systematický artefakt - obraz fixované buňky je vždy odlišný od buňky živé. Různé fixace mohou různým způsobem měnit a zvýrazňovat různé "struktury", nebo ovlivnit jejich barvitelnost při dalším zpracování. Ve výsledku může být velmi obtížné odlišit, kdy se jedná o strukturu přítomnou i v živé buňce a kdy je ona "struktura" artefaktem (kritéria pro definici struktury viz. např. Johansen,1940). Tento problém se daleko výrazněji projeví na cytologické úrovni než při sledování struktury obecně snadno pozorovatelné (buněčné stěny, jádro) na úrovni spíše morfologické. Řešením je kombinace, pokud to jde, sledování fixovaných objektů s vitálními preparáty. Jedinou spolehlivou referenc je živá buňka, která ovšem není u všech systémů dostupná bez výrazné změny nativních podmínek.
Výsledek fixace je ovlivněn dalšími faktory a složkami fixačních roztoků:
teplota - ovlivňuje jak rychlost penetrace, tak rychlost chemických reakcí a to nejen reakce fixativa s komponenty buňky, ale i reakce spojené s metabolismem (autolyze, obranné reakce,.... ). Proto se často používá pro citlivé aplikace fixace při nízké teplotě 4°C. Výhoda nízké teploty může být diskutabilní, protože se snížením teploty dojde, jak bylo uvedeno výše, ke snížení rychlosti působení fixace. V některých případech může vést působení nízké teploty k cytologickým změnám (např. rozpad mikrotubulů)
pH - pH ovlivňuje komponenty buňky (např. konformaci bílkovin, stabilitu membrán). Někteří autoři ukazují, že pH ovlivňuje spíše rychlost autolyze a destrukčních procesů než samotný průběh fixace (Johansen,1940). To ovšem zřejmě neplatí u rychlosti reakce aldehydů s bílkovinami, která je citlivá k pH (nejefektivnější je obvykle při pH 7 - 7,4) (Pearse, 1980). U silně kyselých fixáži dochází k výraznému "rozpouštění" některých struktur (např. vakuol). Optimální pH pro fixaci může být variabilní v rámci buněčných komponent (např. bílkoviny cytoplasmy x bílkoviny jádra) a proto se často používá hodnota blízko optima cytoplasmatických bílkovin, tj. okolo pH 6,8.
používané pufry - koncentrace pufru by neměla vyvolávat výrazné osmotické
změny (obvykle 0,1 - 0,3 Osmol); pufr nesmí reagovat s fixačním činidlem (např.
TRIS nebo EDTA obsahují aminoskupiny které reagují s aldehydy)
nejčastěji používané jsou: fosfátový pufr (0,025 - 0,1M při pH6,8), HEPES (0,05M,
pH7), PIPES
čas - doba fixace určuje množství vzniklých vazeb a efektivitu fixace. Jako příklad lze použít změny aktivity peroxidázy po různých dobách fixace formaldehydem:
rychlost pronikání fixace - spolu s rychlostí reakce vedoucí k fixaci určuje celkovou rychlost fixace objektu. Rychlost pronikání závisí na teplotě, typu fixační látky (např. formaldehyd proniká výrazně rychleji než glutaraldehyd), velikosti a povaze objektu (obtížně proniká impregnovanými vrstvami, kompaktním pletivem, naopak snadno parenchymatickým pletivem s bohatými intercelulárami). To je třeba mít na paměti při odběru vzorků.
dostatečné množství fixáže - zabrání vyčerpání fixující látky a jejímu
naředění přidáním objektu; větší objem znáze pufruje změny, obvykle udávané
množství se podle autorů pohybuje mezi 20-100x objemu pletiva
Některá fixační činidla:
|
Mr =30 |
Obvykle dostupný jako formalín ( 37-40% (saturovaný) vodný roztok formaldehydu).
Roztok je obvykle kontaminován malým množstvím MetOH nebo CHOOH vznikajících
při delším skladování (urychleno skladováním na světle), které mohou mít negativní
vliv na aktivitu některých enzymů a snižovat úspěšnost fixace při náročnější
práci (např. elektronová mikroskopie).
Dalším zdrojem je paraformaldehyd (= polymer formaldehydu), který při
zahřátí uvolňuje plynný formaldehyd a při rozpouštění ve vodě poskytuje jeho
čistý roztok vhodný pro jemnější aplikace.
Jedná se o nekoagulující fixativum, výsledný charakter "obrazu fixace"
závisí na podmínkách (pH, další složky).
Hlavním mechanizmem fixace je tvorba vazeb (můstků) mezi přilehlými bílkovinnými
řetězci, ale může zřejmě interagovat i některými dalšími buněčnými komponenty
(fosfolipidy, fenolické látky)
Doba fixace se obvykle pohybuje mezi 2 a 12h, ale vytvoření maximálního množství
vazeb v pletivu může trvat poměrně dlouho (např. týden) (Pearse,1980). Některé
vzniklé interakce formaldehyd - protein mohou být zvráceny následným vymýváním
vodou. Jejich stabilita vazeb závisí na pH. Za ireverzibilní se považují reakce
s C aromatického kruhu (tryptofan, tyrozin, histidin, fenylalanin), za nejobvyklejší
reakce se považují můstky mezi uhlíky aromatických kruhů nebo aminoskupinami.
Jistá část funkčních skupin zůstává po fixaci formaldehydem volná - lze je použít
pro cytochemické metody. Při fixaci může docházet ke ztrátě lipidů z pletiva
(Baker,1958). Nejčastěji používaným fixačním roztokem je 2-10% pufrovaný roztok.
Vzorky je možné skladovat přímo ve fixačním roztoku po dobu několika měsíců
bez ztráty cytologických detailů.
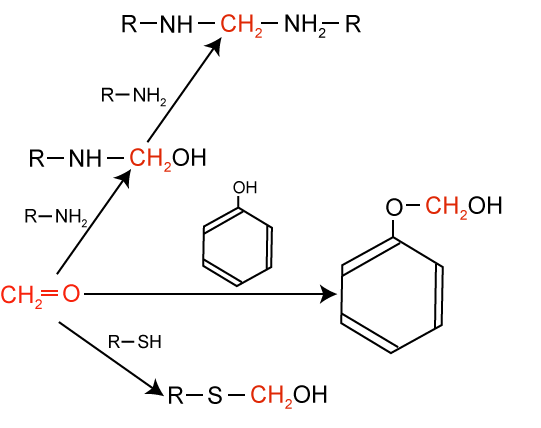
příklady některých obvyklých reakcí při fixaci formaldehydem:
|
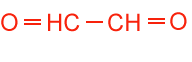 |
Mr = 58 |
Fixativum velmi dobře zachovávající jemné cytologické detaily. Má dvě funkční aldehydické skupiny propojující efektivně bílkoviné řetězce. Ve srovnání s formaldehydem je výrazně silnějším fixačním agens. Právě díky této vlastnosti není ve vyšších koncentracích vhodný pro fixaci objektů, u nichž má být zachována enzymatická aktivita nebo antigenicita, které ovlivňuje daleko výrazněji než formaldehyd. Jeho pronikání pletivem je oproti formaldehydu pomalejší a proto se také často využívá jejich kombinace (Karnowski fixáž). Podobně jako u formaldehydu i glutaraldehyd zachovává semipermeabilní vlastnosti membrán (buňky se stále chovají jako osmometr). Reakce s funkčními skupinami bílkovin se předpokládají obdobné jako u formaldehydu (viz. výše). Kvůli precipitaci v pletivu je nevhodný pro dlouhodobější skladování. Při skladování má tendenci polymerovat a vypadávat z roztoku jako sraženina. Rychlost polymerace je závislá na teplotě a proto je vhodné skladovat glutaraldehyd v lednici nebo mrazáku. Čistota ovlivňuje kvalitu fixace, což je zvláště důležité u elektronové mikroskopie. Glutaraldehyd může být kontaminovaný např. kyselinou glutarovou, glutaraloximem a acroleinem. Některé kontaminace mohou být odstraněny působením aktivního uhlí (O'Brian & McCully (1981). Čistotu roztoku glutaraldehydu lze zjistit spektrofotometricky jako poměr vlnových délek
|
Mr = 46 |
Obvykle se používá jako 50 - 70% vodný roztok. Rychle proniká pletivem. Předpokládá se, že ovlivňuje hlavně terciální strukturu bílkovin narušením hydrofobních interakcí. Díky molekulární struktuře podobné vodě neruší, ale spíše posiluje vodíkové můstky (důleživé pro zachování sekundární struktury bílkovin). Koaguluje bílkoviny, ale ponechává jejich funkční skupiny v značné míře v původním stavu. Rozpouští některé lipidy.
|
Mr =60,05 |
Častá složka fixačních směsí, považovaná za schopnou kompenzovat srážení pletiva, způsobené dalšími komponenty fixáže, antagonistickým působením (bobtnáním pletiva). Tento častý předpoklad (Johansen,1940; Ruzin,1999) je výrazně zpochybněn prácí Zirkleho (1933), dokumentující srážení pletiva po fixaci kyselinou octovou právě tak jako po působení kyseliny chromové. Toto srážení není ale patrné po fixaci, ale až po dehydrataci pletiva a je možné mu zabránit dodatečnou fixací formaldehydem. Některými autory (Johansen, 1940) je kyselina octová považována spíše za "prezervativum" než za "fixativum" a její úlohu vidí v rychlém pronikání pletivem a v tvorbě "kyselého obrazu fixace"
|
Mr =99:99 |
Ve vodném roztoku se vyskytuje jako kyselina chromová. Je silným oxidačním činidlem. Předpokládaný způsob vazby na bílkoviny(Pearse,1980): Soli chromu vytvářejí s vodou komplexy typu Cr-O-Cr,které se vážou na funkční skupiny podobně jako formaldehyd. Zdá se, že hlavním cílem těchto reakcí jsou -COOH a -NH2 skupiny. Dále je známa reakce s fenoly, aminofenoly a katecholaminy, nesoucími orto- nebo para-dihydroxy nebo -diamino skupiny. Nejsou známy přesnější údaje o reakci s jednotlivými funkčními skupinami, proto se obvykle nepoužívá v histochemických studiích. Zanechává pletivo ve stavu náchylném ke srážení během dalšího zpracování. Ruší iontové vazby bílkovin a zvyšuje tím množství volných bazických skupin - zvyšuje acidofilii. Je složkou koagulujících fixačních směsí.
|
Mr =254 |
Použití ve světelné mikroskopii je značně omezené díky velmi pomalému pronikání pletivem. Je velmi silným oxidačním činidlem a jedním z mála efektivních fixativ lipidů.
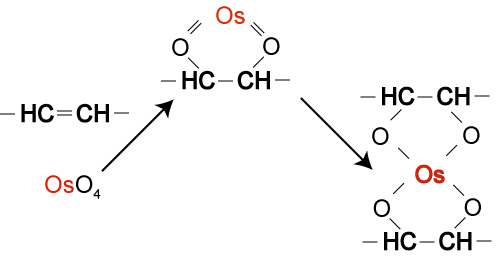
Fixační směsi
Často se používají směsi fixačních činidel. Záměrem jejich autorů často bylo, aby se potlačili (kompenzovaly) nedostatky jedné složky složkou druhou (Ruzin,1999,Johansen,1940). Jako příklad lze uvést FAA - směs Formaldehydu, etanolu a kyseliny octové, ketrá je velmi rozšířená jako obecná fixáž pro anatomické účely. Formaldehyd je zde jako aditivní složka vytvářející propojení mezi bílkovinami. Kyselina octová a ethanol jsou koagulující složky (vytvářejí kyselý obraz fixace), rychle pronikající pletivem. Traduje se, že kyselina octová bu měla působit proti srážení pletiva, ketré je vyvoláno etanolem. Bohužel tento předpoklad nemusí v praxi vždy fungovat (O'Brian & McCully,1981).
Doporučená literatura: